[BMS의 부활] (上) '조현병 치료제' FDA 승인
컨텐츠 정보
- 447 조회
- 25 추천
- 목록
본문
[서울=뉴스핌] 한태봉 전문기자 = 브리스톨 마이어스 스큅(BMS)의 조현병 치료제 코벤파이(Cobenfy, 옛 카엑스티KarXT)가 미국 현지 시각으로 26일에 미국 식품의약국(FDA)의 최종 승인을 받았다. 조현병 치료계열 신약이 FDA의 승인을 받은 건 Clozaril(클로자릴) 승인 이후 무려 35년만의 일이다.
특히 코벤파이(Cobenfy)는 조현병에 대해 세계 최초로 무스카린 수용체를 표적으로 삼는 새로운 방식이라 큰 기대를 모은다. 기존 조현병 약물과 달리 도파민과 세로토닌 수용체를 직접 차단하지 않는 게 특징이다.
이런 기존 약물과 차별화된 작용 메커니즘을 통해 조현병의 부작용인 양성 증상(환청, 망상 등)과 음성 증상(감정적 둔화, 무기력 등) 모두를 최소화할 수 있을 것으로 기대된다.
앞서 2023년에 '브리스톨 마이어스 스큅'는 '코벤파이(옛 카엑스티)'를 손에 넣기 위해 '카루나 테라퓨틱스'를 무려 18조원(140억 달러)에 인수한 바 있다. 이번 FDA의 승인으로 BMS의 M&A 승부수가 빛을 발하는 모양새다.
조사기관에 따라 차이는 있지만 현재 조현병 시장 규모는 연간 약 10조원(75억달러) 규모로 추정된다. BMS에 따르면, 전 세계적으로 약 2400만명이 조현병을 앓고 있다. 또 미국에서만 약 280만명의 환자가 있다.
BMS의 신약 '코벤파이'가 앞으로 조현병 시장에서 얼마나 높은 점유율을 가져올 수 있을 지가 향후의 관전 포인트다. BMS에서는 10월 중에 '코벤파이'를 판매할 수 있을 것으로 전망하고 있다.
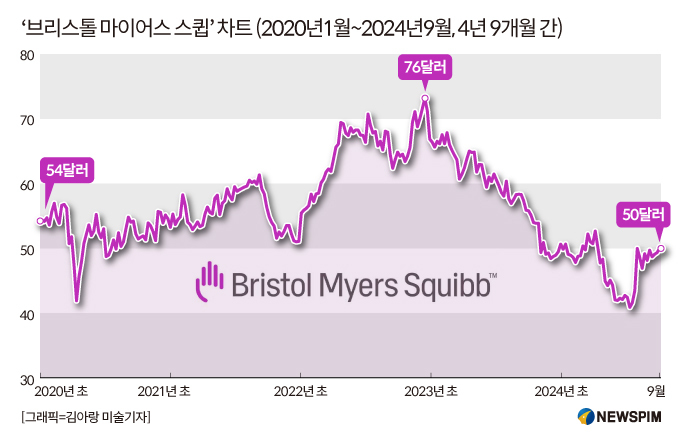
코벤파이(Cobenfy)의 FDA 승인은 9월26일 장 종료 후에 발표됐다. 이후 시간 외 거래에서 매수세가 몰리면서 '브리스톨 마이어스 스큅(BMS)'의 주가는 5% 이상 폭등한 52.5달러에 거래되고 있다.
 |
longinus@newspim.com
관련자료
-
이전
-
다음

